广东地区新生仔猪先天性震颤猪群中PCV3感染情况的调查
来源:华南农业大学动物科学学院 温氏食品集团股份有限公司 2020-05-26 10:11:07| 查看:次广东地区新生仔猪先天性震颤猪群中PCV3感染情况的调查
代锐张昕 李群辉 周庆丰 毕英佐 陈峰
华南农业大学动物科学学院温氏食品集团股份有限公司
批注:猪场圆环病毒的间接影响、造成的损失是不可小觑的。特别是在高强度免疫压力下,圆环病毒在猪场不仅仅是PCV-2,还出现了PCV-3、PCV-4等毒株、亚型。相关报道,可进一步了解阅读《PCV3贵州流行株基因组分析及其Cap蛋白的原核表达研究》、《猪圆环病毒3型衣壳蛋白(Cap)抑制宿主细胞天然免疫应答》、《不容小觑的新型猪圆环病毒:中国部分地区PCV3分子流行病学调查》等。
摘要:
对广东省不同地区新生仔猪先天性震颤猪群中PCV3的流行病学情况进行调查。采集的病料样品,通过常规PCR进行PCV3检测与全基因扩增,分析其全基因的遗传进化关系。将获得的16株PCV3毒株核酸序列与其他环状病毒参考毒株对全基因组和Cap基因进行遗传变异分析,结果显示,新生仔猪的先天性震颤猪群中PCV3样本总阳性率高达58.2%。16株PCV3毒株之间全基因核苷酸序列同源性为99.5%~100%,与美洲代表毒株PCV3-US/MO2015全基因核苷酸序列同源性在98.8%~99.1%之间;16株PCV3毒株之间Cap基因的核苷酸序列同源性为99.7%~100%,与国内外参考毒株的核苷酸同源性为99.1%~100%。遗传进化分析显示,16株PCV3毒株都属于PCV3a分支。PCV3在我国广东省新生仔猪先天性震颤猪群中广泛存在。
猪圆环病毒3型(Porcinecircovirus 3)是一种新发现的圆环病毒,2016年美国通过宏基因组技术从一些患有心肌炎的仔猪中检测到一种新型的猪圆环病毒(Porcine circovirus,PCV),将其命名为PCV3,随后在具有猪皮炎肾病综合征、生殖繁殖障碍和心肌多系统炎症的病猪中检测到PCV3[1]。PCV3属于圆环病毒科(Circoviridae)圆环病毒属(Circovirus),是无囊膜病毒,具有该圆环病毒科家族的环状单链DNA基因组[2]。其基因组全长约为2kb,主要包括3个开放阅读框(ORF),ORF1基因编码的复制酶蛋白(replicase protein,Rep),主要参与病毒DNA的复制[3],ORF2基因编码的核衣壳蛋白(capsid protein,Cap)是主要的结构和抗原蛋白[4],但是PCV3与PCV2的ORF2基因同源性只有37%[2],ORF3基因编码的蛋白目前研究较少,其结构与功能尚不清楚。自2016年以来,PCV3已在多个国家被检测到,包括德国、意大利、中国[5,6,7]等。
先天性震颤多见于新生仔猪,其临床特征是四肢、头部或全身出现有节奏的震颤,虽然全身抖动不直接导致仔猪死亡,但是可以导致仔猪行走、吃奶困难阻碍仔猪进行哺乳,常因初乳摄入不足随后可能导致严重的发育迟缓或饥饿死亡[8]。因此,仔猪先天性震颤对养猪业带来巨大的经济损失。在近一个世纪的过程中,仔猪先天性震颤在许多国家被报道,暗示其是一种世界性疾病[9,10,11,12,13,14]。虽然,它是在近一个世纪以前的文献中被首次报道,大多数现代暴发的仔猪先天性震颤病因作用仍未定义。有文献报道从仔猪先天性震颤中检测出PCV3[15],提示其与该病有密切联系。因此,我们调查了广东省不同地区新生仔猪先天性震颤猪群中PCV3流行情况。
1 材料与方法
1.1 材料
1.1.1 主要试剂
PremixEx TaqTM酶和DNA DL2 000Maker、pMD19-T,宝生物工程(大连)有限公司产品;病毒核酸提取试剂盒Magen RaPure Viral RNA/DNA Kit,Magen公司产品;DNA凝胶回收试剂盒,OMEGA公司产品。
1.1.2 样品来源
2017年2月~2018年4月收集122份样品来源于广东省的36个猪场。发病猪的临床特征是四肢、头部或全身出现有节奏的震颤,经常无法吸吮母乳,导致其营养不良或饥饿致死,采集发病猪的组织样品,包括脑、脾脏、肺脏、淋巴结和血清。
1.2 方法
1.2.1 病料核酸的提取
称取各组织病料0.2g置于匀浆管中,加入不同规格的钢珠和1mL生理盐水后,置于组织匀浆机中匀浆30s,3个循环,匀浆后的样品放置-80℃冰箱,反复冻融3次释放病毒,8 000r/min低温离心5min后获取上清液。取250μL上清按照Magen RaPure Viral RNA/DNA Kit试剂盒说明书进行核酸的提取,置-80℃保存待用。
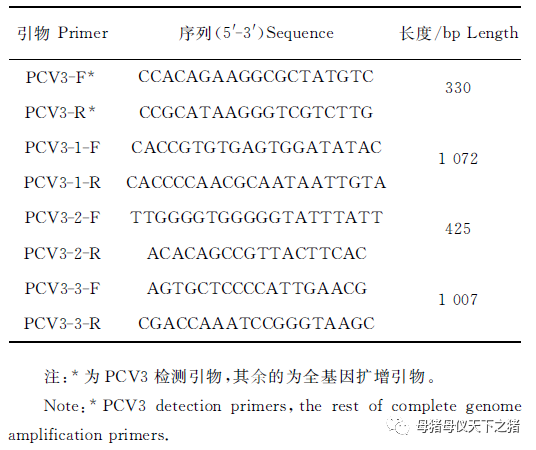
1.2.2 引物设计与合成
参照Palinski R等[2]的研究合成1对引物用于PCV3检测,并参考Fux R等[5]的研究合成3对引物用于PCV3全基因组扩增(表1)。引物由上海生工生物工程技术服务有限公司合成。
表1 PCV3特异基因扩增引物
Table 1 Amplification primers forspecific genes of PCV3
1.2.3PCV3全基因组序列测定与分析
将PCV3阳性样品进行全基因组序列测定,以阳性样品核酸为模板,用表1中的3对引物参考Premix Ex TaqTM酶说明书进行片段扩增。PCV3全基因组扩增体系为50μL:2×Premix Ex Taq 25μL,上、下游引物各取1μL,去离子水21μL,提取的DNA模板2μL。扩增反应条件:95℃预变性5min;94℃30s、55℃30s、72℃70s,共35个循环;72℃后延伸3min。PCR产物用10g/L琼脂糖凝胶电泳检测。
1.2.4 基因克隆与测序分析
选择琼脂糖凝胶电泳为阳性的样品,用DNA凝胶回收试剂盒回收PCR产物,纯化后克隆至pMD19-T载体,对重组质粒进行菌液PCR鉴定,将鉴定为阳性的重组质粒送至深圳华大基因股份有限公司进行测序。
1.2.5PCV3全基因序列拼接及系统进化树分析
将测序获得的3段序列进行拼接,并与国内外参考毒株序列进行比对得到PCV3全基因组序列,应用生物学软件DNA Star V7.1、MEGA 7.0对PCV3全基因组及Cap基因序列与参考毒株序列比对进行核苷酸同源性分析和绘制遗传进化树。
2 结果
2.1 临床样品PCV3的检测
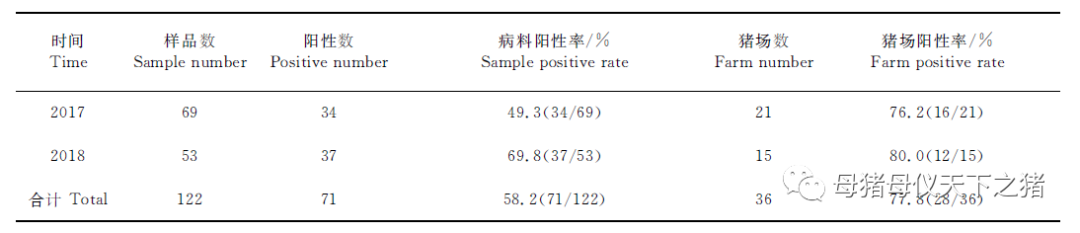
应用常规PCR对36个猪场送检的122份临床样品进DNA行检测,结果显示,122份样品中的71份被鉴定为PCV3阳性,样品总阳性率为58.2%(71/122),2017年和2018年(表2)PCV3临床阳性样品数分别是34份和37份,PCV3的阳性率分别为49.3%(34/69)和69.8%(37/53)。此外,在2017年21个猪场中有16个为PCV3阳性场,猪场阳性率为76.2%(16/21),2018年15个猪场中有12个为PCV3阳性场,猪场阳性率为80.0%(12/15),猪场总阳性率为77.8%(28/36)。表明广东省地区存在PCV3感染。
2.2PCV3的PCR检测及全基因组PCR扩增
经常规PCR检测出为阳性的样品进行PCV3全基因组扩增,3段引物PCV3-1-F/R、PCV3-2-F/R、PCV3-3-F/R经PCR扩增,产物大小与Fux R等[5]研究一致,分别为1 072、425、1 007bp(图1)。将PCR产物送至上海生工生物工程技术服务有限公司进行测序,用于遗传进化分析。
表2 病料样品与猪场水平PCV3的阳性率
Table 2 Detection rates of PCV3insamples and farms
2.3 PCV3全基因组的遗传进化分析
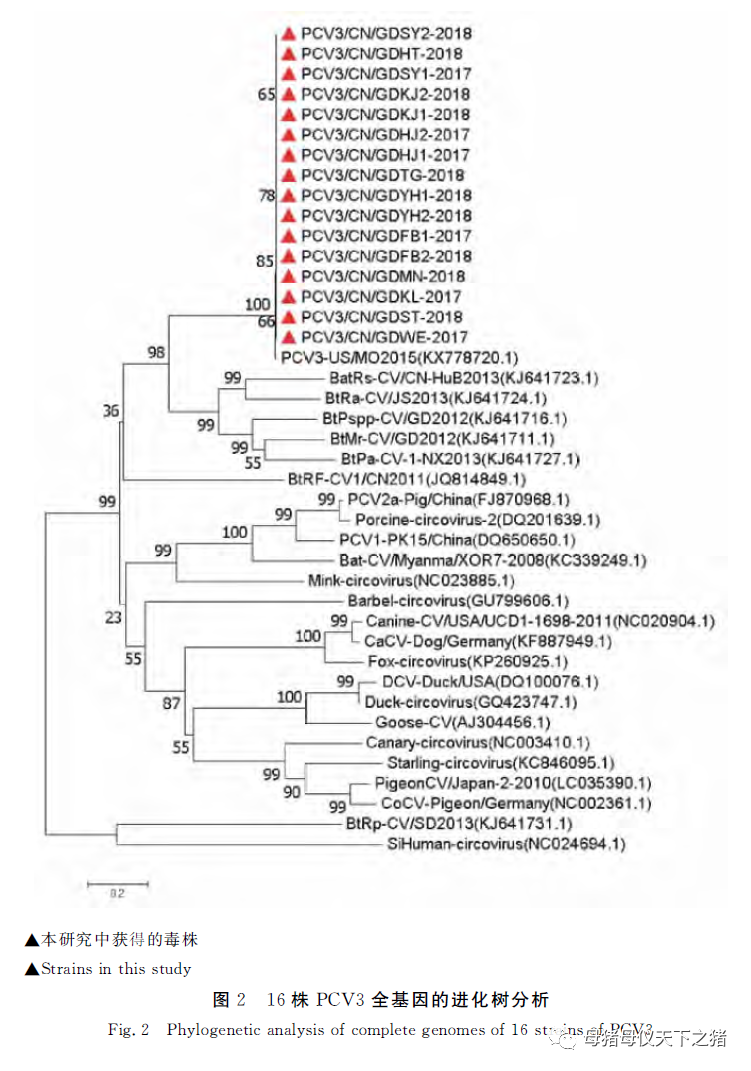
将本研究所获得的16株PCV3毒株与国内外的25株环状病毒参考毒株序列应用DNAStar的MegAline软件进行核苷酸同源性分析,并应用MEGA 7.0构建遗传进化树,分析PCV3全基因组与其他环状病毒参考毒株之间的进化关系。结果表明,16株PCV3毒株之间核苷酸序列同源性为99.5%~100%,但与PCV1、PCV2的核苷酸同源性分别在43.6%~43.9%、44.0%~44.3%之间,与美洲代表毒株PCV3-US/MO2015之间的核苷酸序列同源性为98.8%~99.1%。全基因进化树结果表明,本研究的16株PCV3与最早发现的PCV3-US/2015在同一群中(图2)。
2.4PCV3Cap基因的遗传进化分析
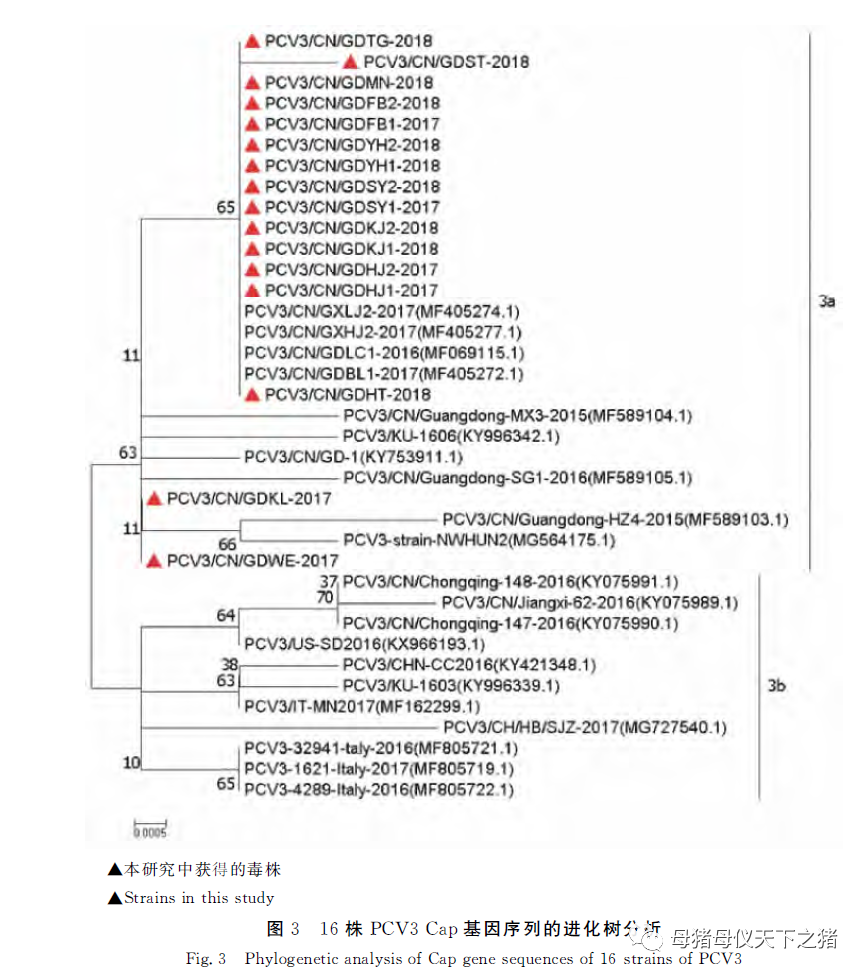
本研究获得的16株PCV3毒株之间Cap基因的核苷酸序列同源性为99.7%~100%,与国内外参考毒株的核苷酸同源性为99.1%~100%;16株PCV3Cap基因推导的氨基酸序列与参考毒株同源性为99.5%~100%。基因进化树分析表明,本研究的16个流行毒株均属于PCV3a亚型(图3)。

3 讨论
先天性震颤通常发生在新生仔猪中,其脑和脊髓表现出严重的病理损伤[8]。新生仔猪的先天性震颤在猪群中普遍存在,并对我国造成了巨大的经济损失[13]。自2016年在美国首次报道PCV3以来,在我国多个省也相继出现PCV3感染的报道。大多数研究表明,PCV3感染与PDNS和生殖障碍有关[2]。而近年有报道称从仔猪先天性震颤的猪群中检测到PCV3[13]。因此,我们对广东省不同地区新生仔猪先天性震颤猪群进行PCV3流行病学调查。
在本研究中,应用常规PCR对临床样品进行PCV3检测,结果发现新生仔猪先天性震颤猪群中PCV3总阳性率高达58.2%(71/122),2017年和2018年PCV3感染率分别为49.3%和69.8%,其感染率有上升的趋势;猪场的阳性率为77.8%。PCV3可以在不同的临床组织样品如脑、脾脏、肺脏、淋巴结及血清等中被检测到,其中脑和淋巴结组织中检出率最高,脾脏次之。大多数的研究[8,9,13,16]表明仔猪的先天性震颤是由猪非典型瘟病毒(AP-PV)引起的。先天性震颤的仔猪,其脑和脊髓表现出严重的病理损伤[8],而本研究发现PCV3在脑中检出率最高,且一些样品APPV呈阴性。这些结果表明,PCV3可能也是引起新生仔猪先天性震颤的一种病原。
此外,通过PCR获得了16株PCV3毒株。基因组全序列分析结果显示,16株PCV3与其他的PCV3毒株相似,他们的全基因组大小均为2 000kb,具有两个反向排列的开放阅读框(ORFs),主要编码Cap和Rep蛋白,与之前报道的其他PCV3毒株进行比较,全基因组没有核苷酸的插入或缺失。序列分析显示,16株PCV3全基因及ORF2基因的核苷酸同源性分别为99.5%~100%和99.7%~100%。Cap基因遗传进化分析结果显示,本研究获得的16株PCV3都分布在3a分支,说明此次从广东地区获得的PCV3流行毒株属于PCV3a亚型。
总之,研究结果表明PCV3在广东省新生仔猪先天性震颤猪群中广泛存在,且遗传进化分析显示都属于3a分支。这些结果对于更好地理解PCV3及其在新生仔猪先天性震颤猪群中的作用至关重要。
参考文献
[1]PHAN T G,GIANNITTI F,ROSSOW S,et al.Detection of a novel circovirus PCV3in pigswith cardiac and multi-systemic inflammation[J].Virol J,2016,13(1):184.
[2]PALINSKI R,PINEYRO P,SHANG P,et al.A novel porcine circovirus distantly relatedto known circoviruses is associated with porcine dermatitis and nephropathysyndrome and reproductive failure[J].J Virol,2016,91(1):JVI.01879-16.
[3]ANNETTE M,RIFAT C,KIM H,et al.Molecular biology of porcine circovirus:analysesof gene expression and viral replication[J].Vet Microbiol,2004,98(2):81-88.
[4]NAWAGITGUL P,MOROZOV I,BOLIN S R,et al.Open reading frame 2of porcinecircovirus type 2encodes a major capsid protein[J].J GeneVirol,2000,81,2281-2287.
[5] FUXR,SOCKLER C,LINK E K,et al.Full genome characterization of porcine circovirustype 3isolates reveals the existence of two distinct groups of virusstrains[J].Virol J,2018,15(1):25.
[6]FACCINI S,BARBIERI I,GILIOLI A,et al.Detection and genetic characterization ofPorcine circovirus type 3in Italy[J].Transb Emerg Dis,2017,64(6):1661-1664.
[7]SHEN H,LIU X,ZHANG P,et al.Genome characterization of aporcine circovirus type3in South China[J].Transb Emerg Dis,2018,65(1):264-266.
[8] DEGROOF A,DEIJS M,GUELEN L,et al.Atypical porcine pestivirus:A possible cause ofcongenital tremor type A-Ⅱin newborn piglets[J].Viruses,2016,8(10):271.
[9]BEER M,WERNIKE K,DRAGER C,et al.High prevalence of highly variable atypicalporcine pestiviruses found in germany[J].Transb Emerg Dis,2017,64,e22-e26.
[10]HAUSE B M,PEDDIREDDI L,GAUGER P C,et al.Discovery of a novel putative atypicalporcine pestivirus in pigs in the USA[J].J Gene Virol,2015,96(10):2994-2998.
[11]MOSENA A C S,WEBER M N,DA CRUZ R A S,et al.Presence of atypical porcinepestivirus(APPV)in Brazilian pigs[J].Transb Emerg Dis,2018,65(1):22-26.
[12]POSTEL A,HANSMANN F,BAECHLEIN C,et al.Presence of atypical porcinepestivirus(APPV)genomes in newborn piglets correlates with congenital tremor[J].SciRep,2016,6(1):27735.
[13]YUAN J,HAN Z,LI J,et al.Atypical porcine pestivirus as a novel type ofpestivirus in pigs in China[J].Front Microbiol,2017,8:862.
[14]ZHANG H,WEN W,HAO G,et al.Phylogenetic and genomic characterization of a novelatypical porcine pestivirus in China[J].Transb Emerg Dis,2018,65(1):e202-e204.
[15]CHEN G H,MAI K J,ZHOU L,et al.Detection and genome sequencing of porcine circovirus3in neonatal pigs with congenital tremors in South China[J].Transb EmergDis,2017,64(6):1650-1654.
[16]MUNOZ-GONZALEZ S,CANTURRI A,PEREZ-SIMO M,et al.First report of the novelatypical porcine pestivirus in Spain and a retrospective study[J].Transb EmergDis,2017,64(6):1645-1649.
服务热线:400-808-6188
Copyright©2010-2022 https://www.zhuwang.cc