七类消毒剂对非洲猪瘟病毒荧光定量PCR检测结果的影响,建议都看看!
来源:猪病诊治 2024-04-10 14:54:55| 查看:
次
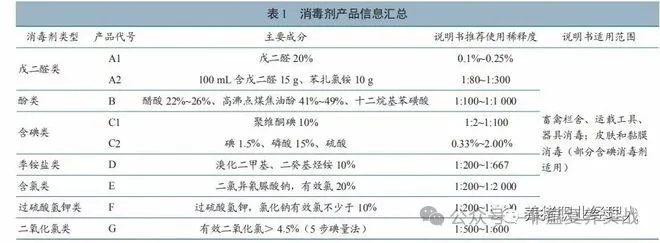
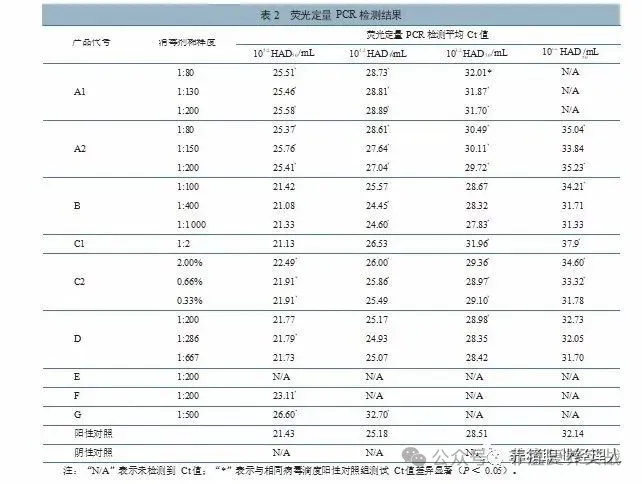
为评价戊二醛、酚、含碘类等常用消毒剂消毒后对非洲猪瘟病毒荧光定量PCR检测结果的影响,基于畜禽栏舍、运载工具、器具消毒及皮肤黏膜消毒目的,按消毒剂说明书推荐选择不同工作浓度,分别与不同滴度的非洲猪瘟病毒培养物于20℃条件下作用30min后,采用荧光定量PCR方法检测作用后产物。结果显示,与对应的阳性对照组相比,含氯类(二氯异氰尿酸钠)、过硫酸氢钾类、二氧化氯类消毒剂,消毒后对荧光定量PCR检测结果影响最显著,检测Ct值显著上升或检测不到;戊二醛类、含碘类(主要成分聚维酮碘)消毒剂,核酸降解能力相对较弱,检测Ct值稍有上升;酚类、季铵盐类、含碘类(主要成分碘、磷酸、硫酸)类消毒剂,检测Ct值基本无变化。本研究评价了7类常用消毒剂消毒对非洲猪瘟病毒荧光定量PCR检测结果的影响,可为防控实践中科学、客观评价分析消毒效果提供技术 技术 1、材料与方法 1.2病毒 1.3试剂与耗材 1.4猪肺泡巨噬细胞、红细胞和血清制备 1.5病毒滴度测定 1.6消毒剂与ASFV作用 1.7病毒DNA提取 1.8荧光定量PCR扩增 技术 1.9检测结果分析 2、结果 2.2各消毒剂检测结果 结果(表2)显示,本研究中不同滴度ASFV与戊二醛类消毒剂作用后,荧光定量PCR检测Ct值均显著上升。与阳性对照组相比,戊二醛类A1产品1:80~1:200稀释下,当病毒滴度为105.2~103.2 HAD50/mL时,检测Ct值上升约3.19~4.15;当病毒滴度为102.2 HAD/mL时,未检测到Ct值。A2产品在1:80~1:200稀释灭活不同滴度病毒后,检测Ct值上升1.21~4.33。技术 技术
【版权声明】 养猪网旗下所有平台转载的文章均已注明来源、养猪网原创文章其他平台转载需注明来源且保持图文完整性、养猪网特别说明的文章未经允许不可转载,感谢您的支持与配合;我们所有刊登的文章仅供养猪人参考学习,不构成投资意见。若有不妥,请及时联系我们,可添加官方微信号“zgyangzhuwang”!